
▲高端疫苗下午5點將召開重大訊息說明會,傳要宣布新冠疫苗解盲結果。(圖/記者湯興漢攝)
記者李佳蓉/採訪報導
高端今天股票暫停交易,預計下午5點線上召開重大訊息說明會,外界認為將宣布新冠疫苗解盲結果。稍早食藥署公布國產新冠疫苗緊急使用授權審查標準,指中和抗體與血清反應率均須達標才能送專家會議審查。前台大感染科醫師林氏璧預測今日解盲的結果,認為WHO未定免疫橋接測中和抗體的指引,食藥署已經盡力了。
食藥署副組長吳明美表示,國產疫苗核發EUA標準在於第二期臨床試驗所得中和抗體效價必須證明不劣於AZ疫苗,其中原型株活病毒中和抗體幾何平均效價比值的95%信賴區間下限須大於0.67,亦即在從國產樣本中取出效價最差者對比AZ疫苗效價平均值,其效益不能低於0.67倍。另外,血清反應比率則依據AZ疫苗60%原型株活病毒中和抗體累積分佈量設定,同樣依照抗體高低值取出前60名進行排名,95%信賴區間下限也不得低於50%。
對於外界關注高端今日將發布第二期臨床試驗解盲結果,前台大感染科醫師林氏璧直言,「今天的解盲其實不存在太大成功、失敗的問題。」他解釋,三期臨床試驗才會有解盲問題,解盲關鍵在於不知道誰打疫苗、誰是對照的安慰劑組,解盲才知道得病組是否多半是打安慰劑的組別,從而算出此疫苗的保護力,但有趣的是,「二期沒什麼好解盲的,實驗室會看測到有受試者會產生中和抗體,就是打疫苗的人,有人沒有,那他就是打食鹽水,這不用解盲就知道了。」
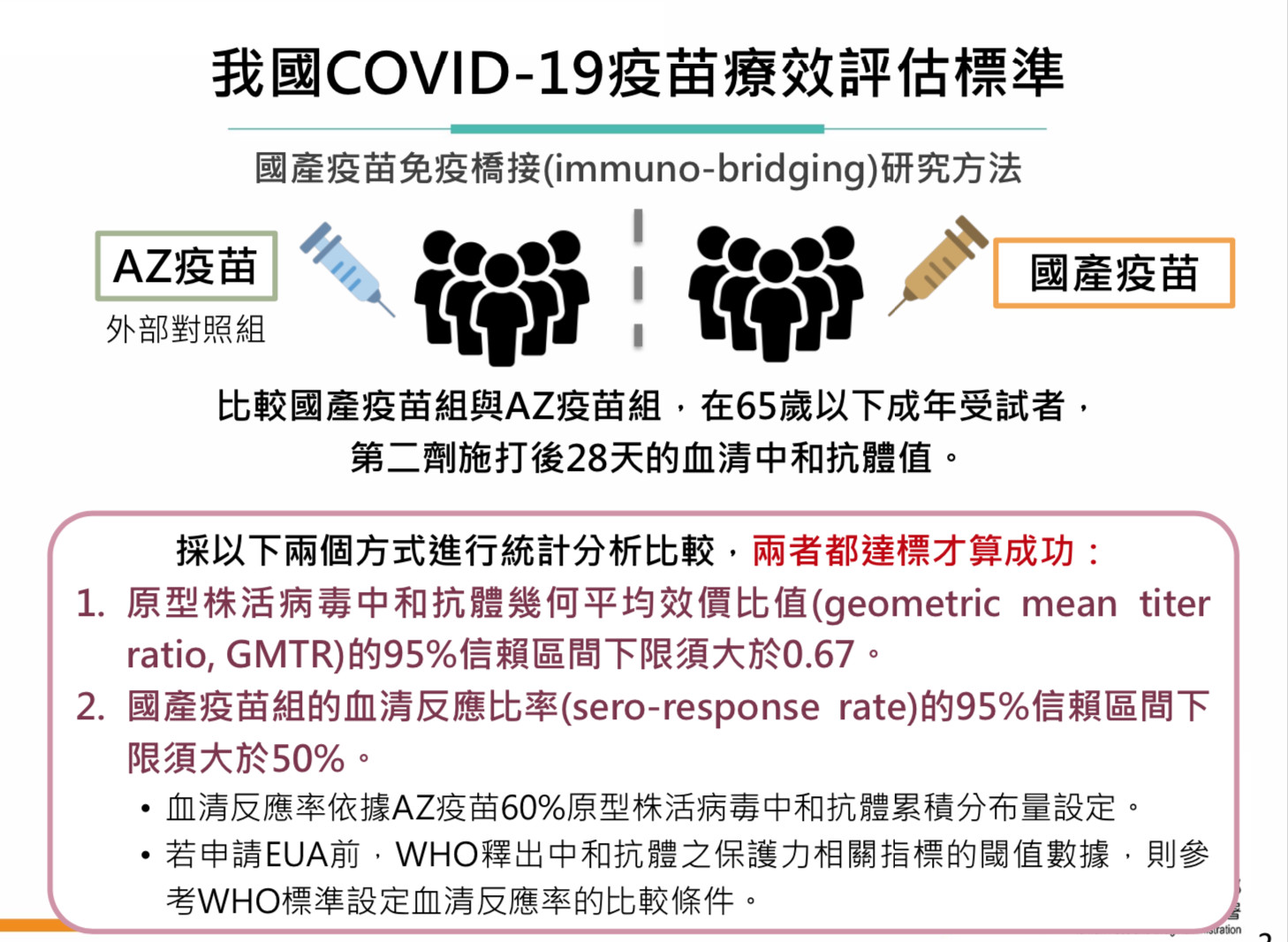
▲國產疫苗療效評估標準。(圖/食藥署提供)
國產疫苗二期面臨的EUA爭議,林氏璧認為專家們應多坐下來溝通,「幫國產疫苗找出一條活路」,大家都希望國產疫苗能成功,提供國人施打抗疫,但專業需要對話,不應該被政治口水淹沒,很可惜。
林氏璧接著說,美國去年大選前FDA力抗川普政治壓力,訂出EUA一定要看到第三期期中報告具有一定保護力和安全性資料標準,然後審查過程透明公開,線上直播會議、諮詢委員都具名投票,贊同反對票數皆公開,「我線上參與了輝瑞莫德納嬌生疫苗的線上會議,歷歷在目。」因此他強調,應做到更透明公開,才是最有效建立民眾對國產疫苗信心的方式。
至於食藥署在高端解盲日上午即公布國產新冠疫苗緊急使用授權審查標準,林氏璧認為,「總比不公布好,但這個公布時機難免會招人批評」。但也能體會食藥署盡力了,去年10月公開簡單標準,卻未將詳細針對療效評估標準寫出,原因在於WHO遲遲未定出標準,若國際已有免疫橋接測中和抗體的指引定出,那麼台灣就解套了。
▲林氏璧說,在WHO未定出免疫橋接的標準前,已先給予國產疫苗EUA,將會引發很大爭議。(示意圖/記者周宸亘攝)
林氏璧說,因審查國產新冠疫苗EUA在即,因此只好硬著頭皮公布細項標準,「但我相信這個方向規劃已久,廠商大概也都知道方向。」因為食藥署3月就委託部立醫院蒐集200位國人接種AZ疫苗之中和抗體結果作為外部對照組,5月初起陸續召開專家會議討論,研商以免疫橋接方式,採用免疫原性(中和抗體)作為替代療效指標,看國產疫苗產生的抗體是否和國外已經EUA的AZ疫苗相當,作為支持國產疫苗療效的佐證。
林氏璧表示,「簡單來說,國產疫苗二期臨床試驗所得中和抗體效價必須證明不能比AZ差,才會EUA。」但最關鍵問題還是免疫橋接是很可能會進行的方向,但在此刻WHO的確未定標準,若在審查是否要給予2個國產疫苗EUA前,國際標準都還沒公佈,「這就是台灣自己訂的,不一定能和國際接軌的標準,會引起很大爭議。」





讀者迴響